- Συγγραφέας Alex Aldridge [email protected].
- Public 2023-12-17 13:36.
- Τελευταία τροποποίηση 2025-06-01 07:36.
Βασική διαφορά - Μεθάνιο εναντίον Αιθανίου
Το μεθάνιο και το αιθάνιο είναι τα μικρότερα μέλη της οικογένειας των αλκανίων. Οι μοριακοί τύποι αυτών των δύο οργανικών ενώσεων είναι CH4 και C2H6 αντίστοιχα. Η βασική διαφορά μεταξύ Μεθανίου και Αιθανίου είναι η χημική τους δομή. ένα μόριο αιθανίου μπορεί να θεωρηθεί ως δύο ομάδες μεθυλίου που ενώνονται ως διμερές ομάδων μεθυλίου. Οι άλλες χημικές και φυσικές διαφορές προκύπτουν κυρίως λόγω αυτής της δομικής διαφοράς.
Τι είναι το μεθάνιο;
Το μεθάνιο είναι το μικρότερο μέλος της οικογένειας των αλκανίων με τον χημικό τύπο CH4(τέσσερα άτομα υδρογόνου συνδέονται με ένα άτομο άνθρακα). Θεωρείται ότι είναι το κύριο συστατικό του φυσικού αερίου. Το μεθάνιο είναι ένα άχρωμο, άοσμο και άγευστο αέριο. επίσης γνωστό ως καρβάνι, αέριο ελών, φυσικό αέριο, τετραϋδρίδιο του άνθρακα και καρβίδιο του υδρογόνου. Μπορεί εύκολα να αναφλεγεί και ο ατμός του είναι ελαφρύτερος από τον αέρα.
Το μεθάνιο βρίσκεται φυσικά κάτω από το έδαφος και κάτω από τον πυθμένα της θάλασσας. Το ατμοσφαιρικό μεθάνιο θεωρείται αέριο του θερμοκηπίου. Το μεθάνιο διασπάται σε CH3- με νερό στην ατμόσφαιρα.
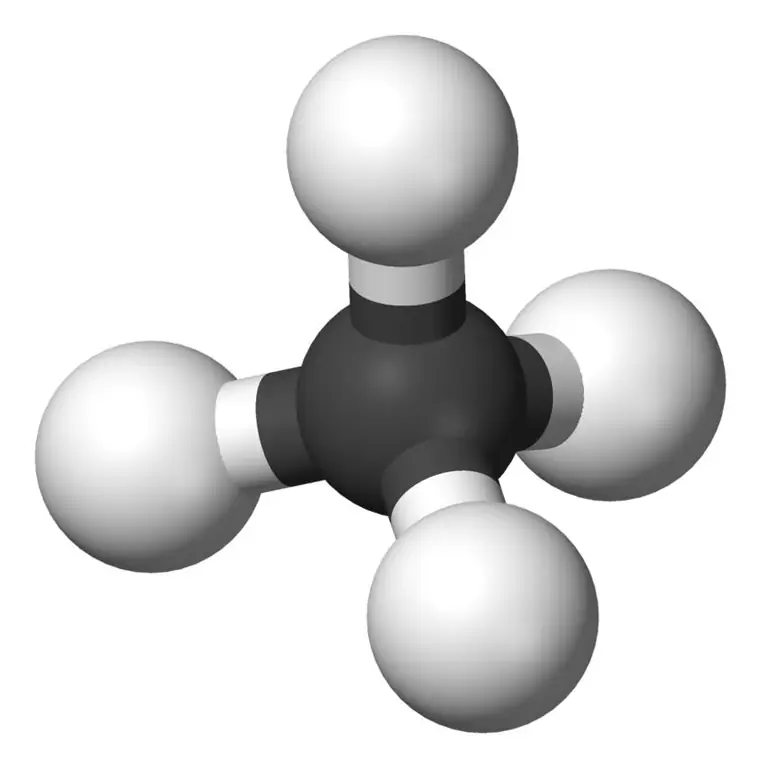
Τι είναι ο αιθάνιος;
Το αιθάνιο είναι μια άχρωμη, άοσμη αέρια ένωση σε τυπική θερμοκρασία και πίεση. Ο μοριακός τύπος και το μοριακό του βάρος είναι C2H6 και 30,07 g·mol−1 αντίστοιχα. Απομονώνεται από το φυσικό αέριο, ως υποπροϊόν από τη διαδικασία διύλισης πετρελαίου. Το αιθάνιο είναι πολύ σημαντικό στην παραγωγή αιθυλενίου.
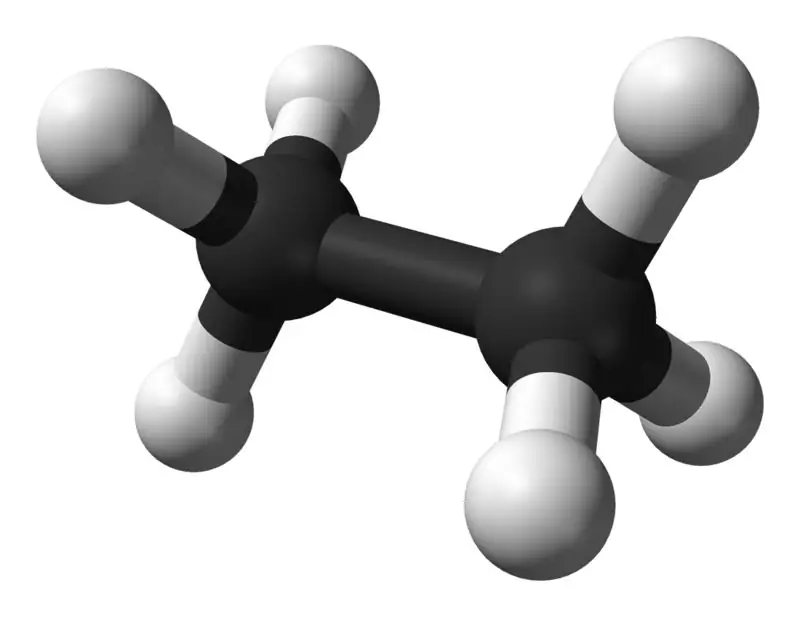
Ποια είναι η διαφορά μεταξύ μεθανίου και αιθανίου;
Χαρακτηριστικά του μεθανίου και του αιθανίου
Δομή:
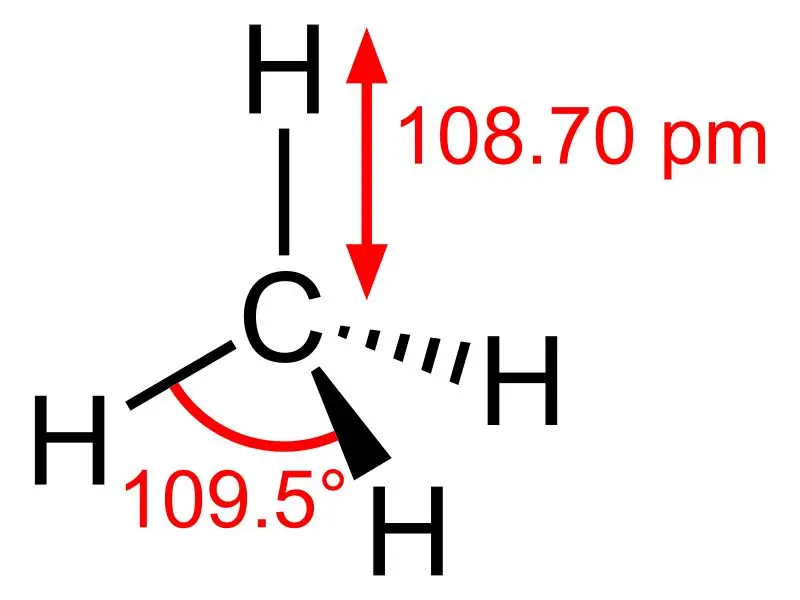
Μεθάνιο: Ο μοριακός τύπος του μεθανίου είναι CH4, και είναι ένα παράδειγμα τετραεδρικού μορίου με τέσσερις ισοδύναμους δεσμούς C-H (δεσμούς σίγμα). Η γωνία δεσμού μεταξύ των ατόμων H-C-H είναι 109,50 και όλοι οι δεσμοί C-H είναι ισοδύναμοι και ισούται με 108,70 pm.
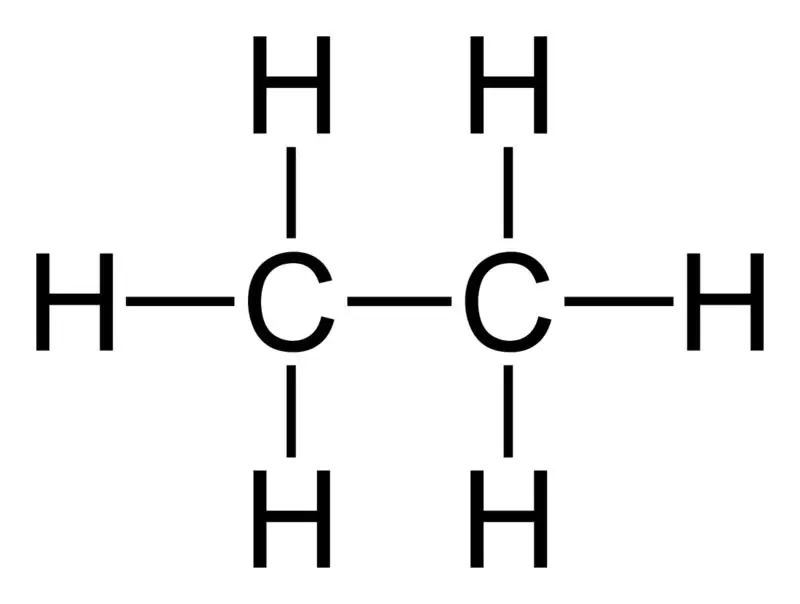
Αιθάνιο: Ο μοριακός τύπος του αιθανίου είναι C2H6,και είναι κορεσμένος υδρογονάνθρακας αφού δεν περιέχει πολλαπλούς δεσμούς.
Χημικές ιδιότητες:
Μεθάνιο:
Σταθερότητα: Το μεθάνιο είναι ένα χημικά πολύ σταθερό μόριο που δεν αντιδρά με το KMnO4, K2Cr 2O7, H2SO4 ή HNO 3 υπό κανονικές συνθήκες.
Κύση: Παρουσία περίσσειας αέρα ή οξυγόνου, το μεθάνιο καίγεται με μια ωχρομπλε μη φωτεινή φλόγα που παράγει διοξείδιο του άνθρακα και νερό. Είναι μια εξαιρετικά εξώθερμη αντίδραση. Ως εκ τούτου, χρησιμοποιείται ως εξαιρετικό καύσιμο. Παρουσία ανεπαρκούς αέρα ή οξυγόνου, καίγεται εν μέρει σε αέριο μονοξείδιο του άνθρακα (CO).
Αντιδράσεις υποκατάστασης: Το μεθάνιο εμφανίζει αντιδράσεις υποκατάστασης με αλογόνα. Σε αυτές τις αντιδράσεις, ένα ή περισσότερα άτομα υδρογόνου αντικαθίστανται από ίσο αριθμό ατόμων αλογόνου και ονομάζεται «αλογόνωση. Αντιδρά με το χλώριο (Cl) και το βρώμιο (Br) παρουσία ηλιακού φωτός.
Αντίδραση με ατμό: Όταν ένα μείγμα μεθανίου και ατμού διέρχεται από μια θερμαινόμενη (1000 K) νικέλιο που στηρίζεται σε επιφάνεια αλουμίνας, μπορεί να παράγει υδρογόνο.
Πυρόλυση: Όταν το μεθάνιο θερμαίνεται στους 1300 Κ περίπου, αποσυντίθεται σε αιθάλη και υδρογόνο.
Αιθάνιο:
Αντιδράσεις: Αέριο αιθάνιο (CH3CH3) αντιδρά με ατμό βρωμίου παρουσία φωτός για να σχηματίσει βρωμοαιθάνιο, (CH 3CH2Br) και υδροβρώμιο (HBr). Είναι μια αντίδραση υποκατάστασης. ένα άτομο υδρογόνου στο αιθάνιο υποκαθίσταται από άτομο βρωμίου.
CH3CH3 + Br2 à CH3 CH2Br + HBr
Καύση: Η πλήρης καύση αιθανίου παράγει 1559,7 kJ/mol (51,9 kJ/g) θερμότητας, διοξειδίου του άνθρακα και νερού.
2 C2H6 + 7 O2 → 4 CO 2 + 6 H2O + 3120 kJ
Μπορεί επίσης να εμφανιστεί χωρίς περίσσεια οξυγόνου, παράγοντας ένα μείγμα άμορφου άνθρακα και μονοξειδίου του άνθρακα.
2 C2H6 + 3 O2 → 4 C + 6 H 2O + ενέργεια
2 C2H6 + 5 O2 → 4 CO + 6 H 2O + ενέργεια
2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + ενέργεια κ.λπ.
Ορισμοί:
Αντιδράσεις υποκατάστασης: Η αντίδραση υποκατάστασης είναι μια χημική αντίδραση που περιλαμβάνει τη μετατόπιση μιας λειτουργικής ομάδας σε μια χημική ένωση και την αντικατάστασή της από μια άλλη λειτουργική ομάδα.
Χρήσεις:
Μεθάνιο: Το μεθάνιο χρησιμοποιείται σε πολλές βιομηχανικές χημικές διεργασίες (ως καύσιμο, φυσικό αέριο, υγροποιημένο φυσικό αέριο) και μεταφέρεται ως υγρό ψύξης.
Αιθάνιο: Το αιθάνιο χρησιμοποιείται ως καύσιμο για κινητήρες και ως ψυκτικό για ένα σύστημα εξαιρετικά χαμηλής θερμοκρασίας. Αποστέλλεται σε χαλύβδινους κυλίνδρους ως υγροποιημένο αέριο υπό τη δική του πίεση ατμών.






